近日,工信部办公厅、国家卫健委办公厅发布《工业和信息化部办公厅 国家卫生健康委办公厅关于开展2024年高端医疗装备推广应用项目申报工作的通知》(以下简称《通知》)。
《通知》指出,面向典型应用场景,遴选一批高端医疗装备技术创新与临床应用水平处于全国前列,对高端医疗装备医工协同创新、中试验证、临床研究、迭代升级与推广应用等具有较强引领带动作用的项目。本年度重点开展诊断检验、治疗、监护与生命支持、养老康复、人工智能辅助诊疗5个方向的高端医疗装备推广应用。
其中涉及磁共振、CT、PET/CT、DSA、彩超、全自动化学发光免疫分析仪、腔镜手术机器人、骨科导航机器人、神经外科手术导航机器人、ECMO、人工耳蜗等多种品类。
具体产品如下:
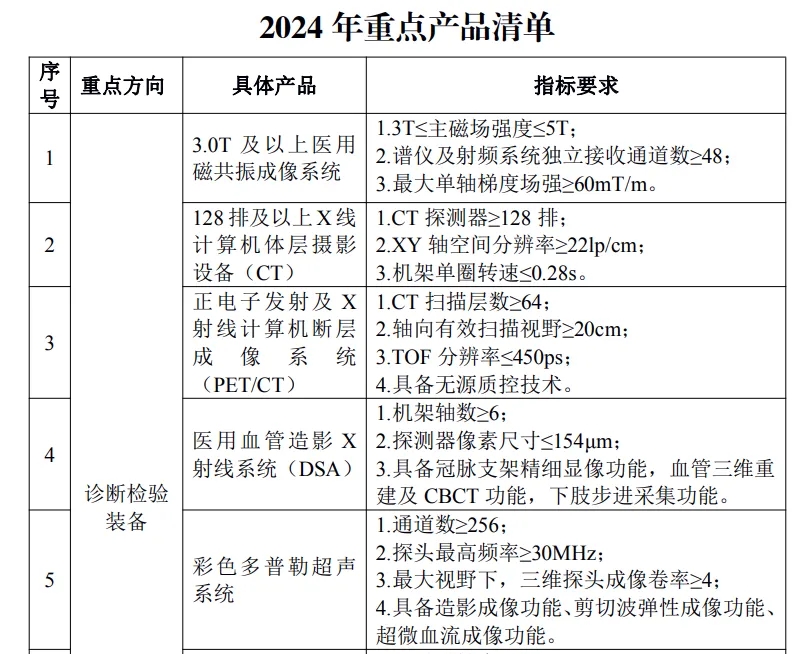
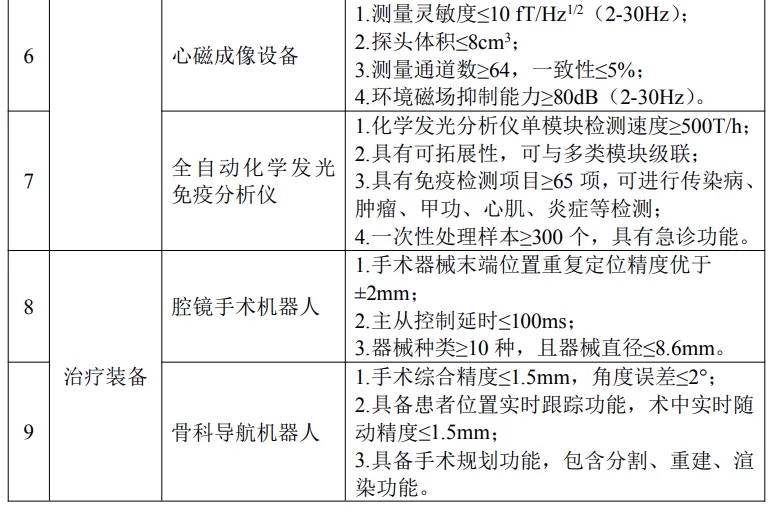
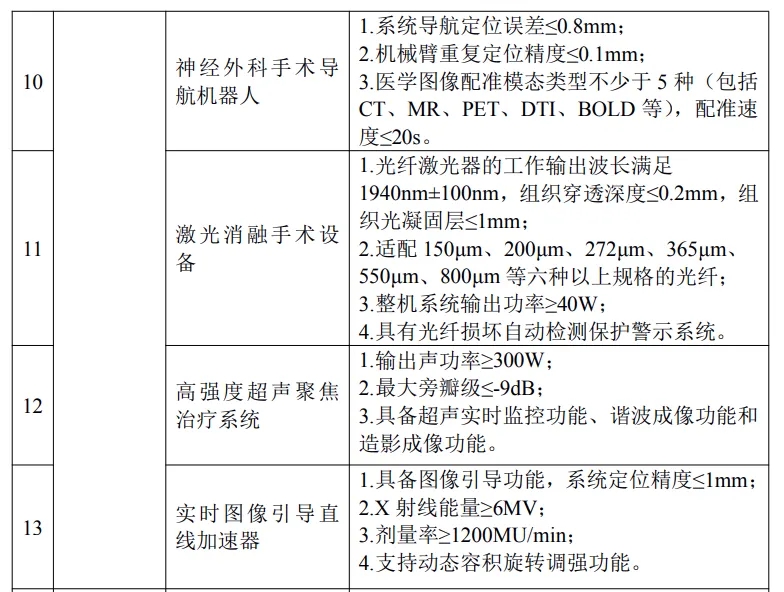
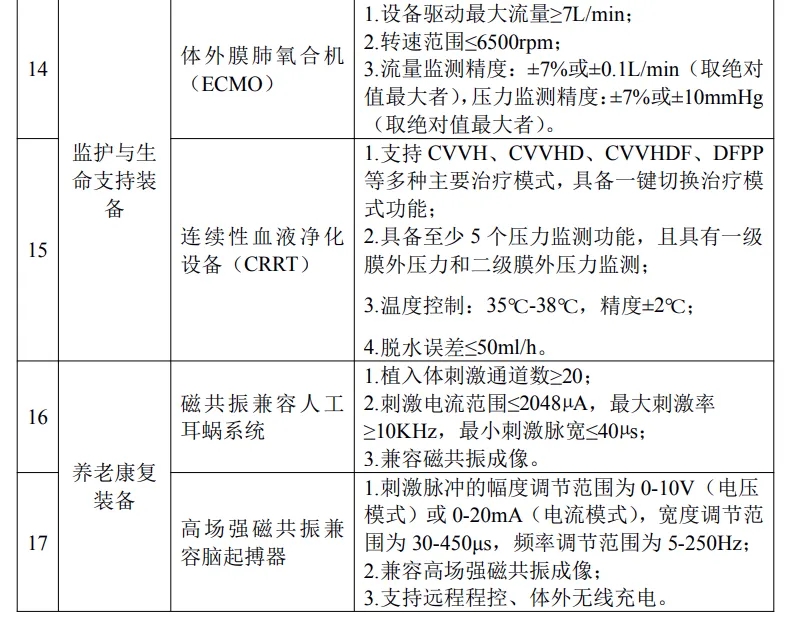
按照文件要求,对所申报推广应用的高端医疗装备产品,牵头医疗装备生产企业须已取得中华人民共和国医疗器械注册证。
医工联合体应建立较为完善的医疗装备研制生产、临床研究管理和资金保障体系,医疗机构重点保障高端医疗装备临床应用研究及推广的技术和环境条件;医疗装备生产企业重点保障高端医疗装备运行安全及改进提升的技术和软硬件条件。
根据《通知》,工业和信息化部、国家卫生健康委组织专家或第三方机构对推广应用项目申报材料进行评审,遴选并公布符合要求的推广应用项目名单。推广应用项目实施周期一般不超过3年。
企稳回暖
医疗器械市场迎新生
过去一年,医疗器械市场在反腐大背景下经历阶段性调整。但伴随反腐常态化以及搁置需求的进一步释放,器械市场也将逐步企稳回暖。
国家层面对于创新药和医疗器械发展高度关注。今年以来,对于生物医药、医疗装备产业的促进政策相继发布。
今年7月,《中共中央关于进一步全面深化改革 推进中国式现代化的决定》通过,其中涉及医疗装备产业发展。具体包括“完善推动新一代信息技术、人工智能、航空航天、新能源、新材料、高端装备、生物医药、量子科技等战略性产业发展政策和治理体系”“健全强化集成电路、工业母机、医疗装备、仪器仪表、基础软件、工业软件、先进材料等重点产业链发展体制机制”“健全支持创新药和医疗器械发展机制”等。
在9月13日召开的国务院新闻办新闻发布会上,国家药品监督管理局局长李利表示,药品监管部门正在按照全会部署,谋划全面深化药品监管改革的一揽子政策措施,着力打造具有全球竞争力的医药创新生态,加快创新药品和医疗器械上市步伐,提高医药产业发展的质量和效益。
其中包括,对国家重点支持的创新药品和医疗器械,在审评审批、检验核查等方面加强服务指导,引导企业坚持以临床价值为导向,以患者为中心制定研发策略。提升创新药品和医疗器械的可及性,落实党中央关于深化“三医”协同发展和治理的决策部署,积极支持创新药械进医院、进医保。
据悉,今年1至8月,国家药监局批准创新医疗器械46个,比去年同期增长12.16%。手术机器人、人工心脏、碳离子治疗系统等高端医疗器械先后上市,部分产品在国际上处于领先地位。
需求端,此前全国范围内有较大体量的院内医疗设备更新需求未释放。
3月,国务院印发《推动大规模设备更新和消费品以旧换新行动方案》,其中明确,到2027年,医疗等领域设备投资规模较2023年增长25%以上。
医疗领域,上述《方案》提出,加强优质高效医疗卫生服务体系建设,推进医疗卫生机构装备和信息化设施迭代升级,鼓励具备条件的医疗机构加快医学影像、放射治疗、远程诊疗、手术机器人等医疗装备更新改造。推动医疗机构病房改造提升,补齐病房环境与设施短板。
此前,全国多省市已相继明确医疗设备采购计划,相关需求将在接下来几年内逐步释放落地,届时,高端医疗设备有望加速进院。
|
上一条:转载:最新盘点!27起医疗科技收购大事件
下一条:转载:创新医疗器械政策现状及发展路径探讨 |
返回列表 |